TROMBOFILIA
Trombofilia é a propensão a desenvolver trombose devido a anomalias no sistema de coagulação. As bases genéticas das trombofilias incluem mutações em diferentes genes que codificam para fatores hemostáticos, podendo ocorrer de forma isolada ou combinada.
O tromboembolismo venoso (TEV) é uma desordem multifatorial que engloba diferentes fatores genéticos de predisposição, além dos fatores ambientais que interagem para a ocorrência do fenômeno trombótico. A TEV afeta de um a três indivíduos em cada mil habitantes e é estimado que 60% da predisposição à trombose seja atribuída a componentes genéticos.
Destacam-se os polimorfismos genéticos relacionados à ocorrência desse evento, como a mutação G1691A no Fator V de Leiden, a mutação G20210A no gene da protrombina, mutações C677T e A1298C no gene da enzima metilenotetrahidrofolato redutase (MTHFR), mutação C536T no gene inibidor da via do fator tecidual (TFPI), polimorfismo I/D no gene codificador da enzima conversora da angiotensina (ECA), polimorfismos 4G/5G do gene inibidor do ativador do plasminogênio tipo 1 (PAI-1) e mutações no gene cistationina betassintase (CBS).
Fator V de Leiden
A trombofilia associada ao Fator V de Leiden é caracterizada pela resistência do fator V à clivagem pela proteína C ativada, constituindo importante fator no aumento de risco para desenvolvimento de tromboembolismo venoso. A mutação, caracterizada pela substituição de G para A, na posição 1691 do gene F5, está presente em 3 a 5% da população caucasiana em heterozigose, sendo menos comum em outras etnias. O risco de trombose é de aproximadamente três a dez vezes maior em indivíduos heterozigotos e, em indivíduos homozigotos, o risco é aumentado em até 80 vezes. A heterozigosidade para o fator V de Leiden também está associada a um aumento do risco de perda fetal de duas a três vezes, e possivelmente outras complicações da gravidez, como pré-eclâmpsia/eclâmpsia, crescimento fetal alterado e descolamento de placenta.
Protrombina
A presença da mutação G20210A no gene da protrombina é encontrada em 18% das pessoas com distúrbios da coagulação, aumentando o risco de formação de coágulos sanguíneos em quase três vezes. Essa mutação também está relacionada à doença arterial coronariana, especialmente em mulheres jovens e pessoas com acidente vascular cerebral.
MTHFR
A MTHFR é a enzima-chave para o metabolismo do folato e está envolvida na remetilação de homocisteína em metionina. Os polimorfismos do gene MTHFR (C677T e A1298C) estão associados à diminuição da atividade da enzima e o aumento da concentração plasmática de homocisteína, conhecida como hiperhomocisteinemia. A hiperhomocisteinemia, por sua vez, é um fator de risco estabelecido para ocorrência de trombose venosa, sendo associada a um aumento de risco trombótico da ordem de duas a quatro vezes.
ECA
A ECA está envolvida no processo de conversão da angiotensina I para a angiotensina II. Quando esse processo acontece, ocasiona o estreitamento dos vasos sanguíneos, aumentando a pressão sanguínea em todo o corpo. A ECA desempenha um papel fundamental no sistema renina-angiotensina. Mutações nesse gene estão associadas a diversos problemas cardiovasculares.
PAI-1
O polimorfismo de inserção/deleção (rs1799889*) na região promotora do gene SERPINE1 (também conhecido como gene PAI-1) é bem caracterizado: o contexto de cinco nucleotídeos guanina (G), chamado de alelo 5G, é considerado o alelo principal, enquanto uma deleção de um nucleotídeo G resulta no alelo 4G, rs1799889(-). Notadamente, indivíduos homozigotos para o alelo 4G têm concentrações elevadas da expressão do gene PAI-1 quando comparados com indivíduos que têm o alelo 5G. Indivíduos portadores do alelo 4G, principalmente quando associados a outros fatores de risco, têm risco aumentado de infarto do miocárdio e eventos tromboembólicos. Altas concentrações de PAI-1 foram encontradas em mulheres com aborto precoce de causa desconhecida.
Gene CBS
A homocistinúria clássica por deficiência em cistationina betassintase (CBS) é uma doença autossômica recessiva do metabolismo da metionina e é acompanhada por abundantes e variadas anomalias clínicas e patológicas, envolvendo principalmente quatro órgãos ou sistemas: olhos, esqueleto, sistema nervoso central e sistema vascular. Foi também descrito o envolvimento de outros órgãos, incluindo o fígado, o cabelo e a pele. De acordo com os dados coletados em países que efetuaram o rastreio de mais de 200.000 recém-nascidos, a atual taxa de detecção cumulativa da deficiência de CBS é de 1 : 344.000. Em diversas áreas específicas, a incidência referida é muito superior. O objetivo do tratamento da homocistinúria clássica varia de acordo com a idade do diagnóstico. Se a deficiência de CBS for diagnosticada no recém-nascido, como idealmente deveria acontecer, o objetivo é prevenir o desenvolvimento das complicações oculares, ósseas e trombóticas intravasculares e assegurar o normal desenvolvimento psicomotor. Por outro lado, se o diagnóstico for feito tardiamente quando já se verificaram algumas complicações, então, o objetivo do médico deve ser a prevenção dos eventos trombóticos que implicam risco de vida e, também, a prevenção do agravamento das complicações já existentes. Para cumprir esses objetivos clínicos no tratamento, é necessário controlar ou eliminar as anomalias metabólicas resultantes da deficiência de CBS.
Indicações
• Pacientes que vão iniciar o uso de contraceptivos orais;
• Mulheres que pretendem engravidar;
• Ocorrência de abortos de repetição;
• Histórico familiar positivo para trombose.
Aplicações
As trombofilias são consideradas uma das causas de perdas gestacionais e respondem por aproximadamente 50 a 65% dos abortos de repetição (AR) de etiologia indefinida. Além disso, o uso de contraceptivos orais (ACO) está associado a um aumento de três vezes na incidência de TEV, sendo que o risco parece ser proporcional à dose de estrogênio e ao tipo de progestágeno. Mulheres heterozigotas para a mutação do Fator V de Leiden usuárias de ACO têm risco cinco vezes maior do que as não usuárias. A mutação do Fator V de Leiden é a causa hereditária mais comum de TEV, presente em cerca de 30% dos indivíduos acometidos, seguida pela mutação do gene da protrombina. Portadoras de mutação do Fator V de Leiden têm risco 30 vezes maior de desenvolver trombose venosa profunda (TVP). Portanto, em pacientes com história pessoal ou familiar de trombose, tal rastreamento deve ser feito.
Os ACOs não devem ser usados em pacientes com mutação no Fator V de Leiden e deficiência de proteína C, S e antitrombina III, uma vez que aumentam significativamente o risco de tromboembolismo venoso. Entretanto, o risco de TEV durante a gestação nessas pacientes é maior do que o associado ao uso de contracepção hormonal. O uso do progestínico isolado não foi relacionado com o aumento do risco de TEV e pode representar uma opção adequada para mulheres portadoras de trombofilias. Métodos de barreira ou dispositivos intrauterinos são também escolhas possíveis.
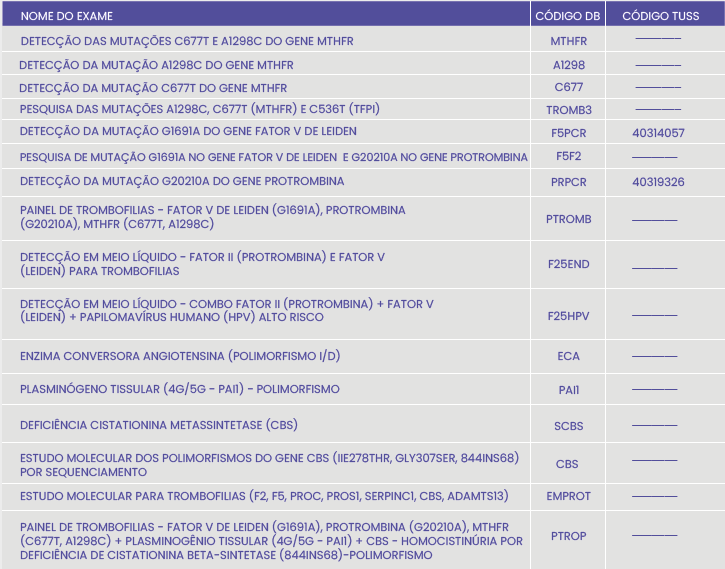
Veja no quadro abaixo os exames oferecidos pelo DB Molecular:
Como solicitar?
Identificar o alvo da pesquisa (gene ou mutação) e a metodologia a ser utilizada (sequenciamento, PCR, etc)
Ex.:
- Sequenciamento completo do gene CBS;
- Pesquisa da mutação G1691A do gene fator V de Leiden.
Referências
ADAMS, Murray J. et al. Polymorphisms of the tissue factor pathway inhibitor gene are associated with venous thromboembolism in the antiphospholipid syndrome and carriers of factor V Leiden. Blood Coagulation and Fibrinolysis: um jornal internacional em hemostasia e trombose. [S. l.]. set. 2007. Disponível em: https://journals.lww.com/bloodcoagulation/pages/results.aspx?txtKeywords=polymorphisms+of+the+tissue+factor+ pathway+inhibitor+gene+are+associated+with+venous+thromboembolism+in+the+antiphospholipid+syndrome+and+carried+of+factor+v+leiden.
Download




